分子的性质
【教材分析】本节是在学习了共价键和分子立体结构的基础上,进一步来认识分子的重要性质,从而达到利用物质性质的最终目标。初步认识物质的结构与性质之间的关系,帮助同学建立基本化学观念之一——“物质结构决定物质性质,性质反映结构”。并能从这一视角解释一些化学现象,推测物质的重要性质——分子的极性等。
【设计思路】从身边的事实“肥皂、洗涤剂能去油污”入手,结合已学的化学键等结构知识,对比分析H2、HCl中的化学键,从而得出键的极性这一概念。再过渡到分子极性的讨论,从概念本质——“正、负电荷中心是否重合”以及物理中“共点力的合力是否为零”两条渠道,拓宽思维面,并设计两个实验来加以验证。
为了突破本节的教学难点:分子结构与分子极性的关系,正确判断分子中正、负电荷中心是否重合成为关键。基于同学们已经学习了“力”的知识,通过转化,建立“物理”模型,将“电负性”的概念转变为“力”;将“正、负电荷中心是否重合”转变为“共点力的合力是否为零”。再结合直观教具——球棍模型,以及电脑动画等多媒体辅助教学手段,将“分子中各个键的极性的向量和是否等于零”转化为直观的、可操作的“判据”,以简驭繁、化生为熟,同时着力培养学生举一反三的能力。
【教学目标】
知识与技能
1.了解极性共价键和非极性共价键、极性分子和非极性分子的概念;
2.了解化学键的极性与分子的极性的关系;
3.结合常见物质分子立体结构,判断极性分子和非极性分子。
过程与方法
通过引导学生观察、对比、分析、实验、建立模型和抽象思维,向学生渗透化学学科研究的基本思想方法:
①从宏观到微观,探究“结构决定性质,性质反映结构”的关系;
②从现象到本质,加强实验和理论的结合,协同揭示化学中的“因果”关系。
情感态度与价值观
1.培养学生求实、合作、进取的优良品质和严谨认真的科学态度;
2.通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
【教学重点】共价键的极性与分子的极性的关系
【教学难点】多原子分子中,极性分子和非极性分子的判断。
【教学准备】球棍模型、教学课件、实验准备
【教学实录】
【科学视野引入】在洗衣服的时候,经常有这种现象,直接用水洗油污,会洗不净,用肥皂、洗涤剂却可以洗去衣服上的油污,通过阅读教材46页的“科学视野”,请同学们自己先来了解一下其中的原因。
【过渡】在“科学视野”里提到了有关分子性质的一些问题,其中原因还得从研究它们的结构开始。
【复习提问】1.什么是化学键?举例说明离子键、共价键。
2.写出H2、Cl2、N2、HCl、CO2、H2O的电子式。
【学生回答】1.化学键是指直接相邻原子间强烈的相互作用;离子键是指阴、阳离子间强烈的静电作用;共价键是指原子间通过共用电子对所形成的相互作用。
2.略
【动画演示】H2、HCl中共价键的形成过程
【问题讨论】H2、HCl都是靠共价键形成的分子,共用电子对在两原子间出现的机会是否相同?其共价键是否相同?
【学生讨论回答】不同,共用电子对位置不同
【教师引导】从两共价键的组成原子、原子吸引电子对能力、共用电子对位置、成键原子电性等方面分析,二者皆不相同。
【板书】一、非极性键、极性键
【引导学生完成下表】
共价键特征 | H2 | HCl |
组成原子 | 相同原子 | 不同原子 |
原子吸引共用电子对能力 | 相同 | 不同 |
共用电子对位置 | 不偏移 | 偏移 |
成键原子电性 | 电中性 | 显电性 |
【板书】在单质或化合物中,两原子间形成的共价键,若共用电子对不偏向任何一个原子,则形成的是非极性共价键,简称非极性键;否则是极性共价键,简称为极性键。
【提问】如何判断极性键和非极性键?
【学生讨论回答】一般说来,同种原子形成的共价键中的电子对不发生偏移,是非极性键。
而由不同原子形成的共价键,电子对会发生偏移,是极性键。
【练习】指出物质中的共价键类型:
1、O2 2 、CH4 3 、CO2 4、 H2O2 5 、Na2O2 6 、NaOH
(1.非极性键 2.极性键 3.极性键 4.极性键、非极性键 5.非极性键 6.极性键)
【思考与交流】共价键有极性、非极性之分,以共价键结合的分子是否也存在极性、非极性之分呢?
【动画演示】H2、HCl分子的形成过程
【学生小组讨论总结归纳】H2分子中,共用电子对不偏向,两个H原子都不显电性,整个分子的电荷分布均匀;HCl分子中,共用电子对偏向Cl原子,Cl原子一端相对地显负电性,H原子一端相对地显正电性,正电中心与负电中心不重合,整个分子的电荷分布不均匀
【板书】二、非极性分子、极性分子
【引导归纳】从H2分子是非极性分子,HCl分子是极性分子不难得出分子极性的概念。
【板书】非极性分子:正电中心与负电中心重合的分子
极性分子:正电中心与负电中心不重合的分子
【问题讨论】以下双原子分子中,哪些是极性分子,哪些是非极性分子?
N2 O2 Cl2 CO
【引导学生归纳】以极性键结合的双原子分子为极性分子;以非极性键结合的双原子分子为非极性分子
【问题讨论】以下化合物分子中,哪些是极性分子,哪些是非极性分子?
CO2 H2O NH3 BF3 CH4
【多媒体展示】CO2、 H2O、 NH3、 BF3、CH4等分子模型
【方法引领】对于多原子分子,该如何分析?以CO2为例,从概念出发分析正电中心与负电中心是否重合,表示如下左图:
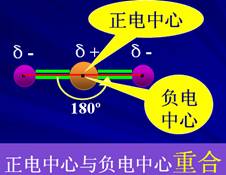
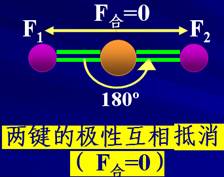
另外,为了加深理解,我们也可以通过物理学中的“合外力是否为零”的方法来加以分析,表示为上右图。
【学生活动】结合H2O、NH3、BF3、CH4等分子的球棍模型,运用“合外力是否为零”的方法判断它们的极性。
【学生归纳】含极性键的多原子分子有没有极性,必须依据分子中极性键的极性向量和是否等于零而定。
当分子中各个键的极性的向量和等于零时,是非极性分子。如:CO2、BF3、CH4等;
当分子中各个键的极性向量和不等于零时,是极性分子。如:HCl、H2O、NH3等 。
【引导学生完成下表】
分子 | 共价键的极性 | 分子中正负电荷中心 | 分子的极性 | 举例 |
同核原子分子 | 非极性键 | 重合 | 非极性分子 | H2、N2、O2、p4、C60 |
异核双原子分子 | 极性键 | 不重合 | 极性分子 | CO、HCl |
异核多原子分子 | 分子中各键向量和为零 | 重合 | 非极性分子 | CO2 、BF3、CH4 |
分子中各键向量和不为零 | 不重合 | 极性分子 | H2O、HCN、NH3、CH3Cl |
【学生小组讨论总结归纳】共价键极性与分子极性关系的一般规律
a. 以极性键结合成的双原子分子是极性分子。如:HCl、HF、HBr;
b. 以非极性键结合成的双原子分子或多原子分子是非极性分子。如:O2、H2、p4、C60;
c. 以极性键结合的多原子分子,有的是极性分子也有的是非极性分子;
d. 在多原子分子中,中心原子的价电子都用于形成共价键,且结合的原子又是相同的原子,一般是非极性分子。
【过渡】以上从理论上探讨了分子有极性分子和非极性分子之分,“实践是检验真理的唯一标准”。
【实验】(1)在酸式滴定管中,注入30 mL蒸馏水,夹在滴定管夹上,并在滴定管下方放一个大烧杯。打开活塞,让水缓慢下流如线状。把摩擦带电的玻璃棒或塑料棒接近水流,观察水流的方向有无变化;用CCl4代替水,重复上述实验,观察有无变化。
(2)分别将盛有冰块和碘的两个小烧杯放入微波炉中(功率选择“中”或“高”),“加热”30~60s,取出烧杯对比它们的变化。
【引导】请学生描述实验现象,师生交流、讨论并解释原因。
[实验1]中:水流发生偏移而CCl4液流不发生偏移。由于H2O为极性分子,而CCl4是非极性分子,当电场存在时,H2O发生偏移,CCl4不发生偏移。
[实验2]中:冰已熔化,但很容易升华的碘却没有明显变化。当把极性分子置于高频交变的电磁场之中(每秒钟振动频率为几十亿次的微波),这些极性分子即随之运动,也就摩擦产生高热,而非极性分子却不能产生振动。
设计意图:利用学生非常熟悉的滴定管、微波炉,却也能演绎出较为深刻的化学原理,一下子就紧紧“抓住”了学生的兴致,从而也必将调动思维到至高点。同时,他们又一次体验到了化学在生活中无处不在,感受了学习化学知识的重大意义与作用。
【回归科学视野】播放肥皂去污原理动画
【课堂小结】通过本堂课的学习,各人总结自己的收获。
【案例练习】
1、请指出表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并与同学讨论你的判断方法。
分子 | 空间构型 | 分子有无极性 | 分子 | 空间构型 | 分子有无极性 |
O2 | HF | ||||
CS2 | H2S | ||||
BF3 | NH3 | ||||
SiCl4 | CH3Cl |
【拓展延伸】
1、根据下列要求,用电子式各表示出一个实例:
(1)、只含有极性键并有一对孤对电子的分子;
(2)、只含有离子键、极性共价键的物质;
(3)、只含有极性共价键、常温下为液态的非极性分子。
2、你还能从身边的哪些事实或现象说明分子确有极性分子和非极性分子之分?还有哪些不同性质?请列举。
设计意图:将布置作业说成拓展延伸,不仅说法上有新意,而且在内容上也有所创新,课后思考题2与开始引入新课的情景遥相呼应,富有课堂探究互动向课后延伸的意味,使来源于生活的知识又应用于生活,并为下节课的学习打下铺垫。
【教学后记】
本案例利用了学生已有的生活体验和知识经验,创设了较好的教学情景,在此情景中提出问题,通过理论分析、实验探究、交流讨论等活动来认识分子的结构和极性的关系,同时整堂课首尾呼应。
通过设置台阶,增加知识及其运用的梯度,培养了学生分析推理、联想类比、归纳总结、模仿创造的学习能力。充分发挥学生学习的主动性,保证课堂的“有效性”,同时也培养了学生的合作能力,较好的体现了新课程的理念。
本案例尊重学生的认知水平(回避了O3的极性、CO中原子电性的反常),而是将学生知识背景尚不足以深入的细节留给学生日后去达到,开个窗口;同时又遵循学科知识的科学性和严谨性,通过适度的“解释”,以给学生今后的学习留有发展空间,符合“以人为本”的教学要求。
中考 高考名著
常用成语