化学能与电能 教学设计7
(一)教材分析初中化学已经从燃料的角度初步学习了“化学与能源”的一些知识,在选修模块“化学反应原理”中,将从科学概念的层面和定量的角度比较系统深入地学习化学反应与能量。人教版高中化学必修2第二章第二节《化学能与电能》部分既是对初中化学相关内容的提升与拓展,又为选修“化学反应原理”奠定必要的基础。由于学生之前没有电化学的基础,理解原电池原理有一定的难度。第一课时的主要内容有:原电池的概念、原理、组成原电池的条件。原电池原理和组成条件是本节课的重点,原电池原理是本节课的难点。第二课时的主要内容是:介绍几种常见的化学电源在社会生产中的应用。通过原电池和传统干电池(锌锰电池)初步认识化学电池的化学原理和结构,并不要求上升为规律性的知识;通过介绍新型电池(如锂离子电池、燃料电池等)体现化学电池的改进与创新,初步形成科学技术的发展观。激发学生科学知识的求知欲。本节教材设置了大量的探究教学素材,富有深刻的自主探究教学思想内涵。首先,原电池概念引入的演示实验2-4为探究教学创设了问题情景,当学生观察到 “铜片上产生气泡”这一反常的实验现象(即学生遇到新的问题——冲突),就会情不自禁地提出一系列问题,产生强烈的探索欲望,并提出各种各样的假设(试图用原有的认知结构去同化——解惑);学生根据实验现象,经过严密的逻辑推理,得出相关结论(达到认知上的新平衡——感悟);当学生理解原电池的原理后,教材又设置了一个“科学探究”和“思考与交流”栏目,让学生自己探究讨论归纳出“组成原电池的条件”( 促进学习者认知结构的不断发展——升华);同时,课本插图“水果电池”,是本课时探究教学内容的应用和延伸(迁移和拓展———发展)。(二)教学设计思路(1)教师创设情景,通过介绍材料(利用化学史实——伏打电池的发明创设教学情景,提出关于化学能如何转化为电能的问题,沿着伏打发明电池的历程开始自主探究)。得到启发,沿着伏打发明电池的历程,设计、动手实验探讨原电池原理。然后开展第二个探究性实验:通过提供材料,让学生设计实验方案,分组讨论、得出最佳方案,探讨构成原电池的条件。最后开展第三个探究性实验:利用所学知识,根据现有材料,制作水果电池,让学生体验学习化学乐趣。(2)生活在现代社会,学生对“电”有着较丰富的感性认识。要充分利用学生已有的经验,以及电学、化学反应中能量变化和氧化还原反应等知识,调动学生主动探索科学规律的积极性。通过实验探究,引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。(3)通过原电池和传统电池(锌锰电池)初步认识化学电池的化学原理和结构,并不要求上升为规律性的知识;通过介绍新型电池(如锂离子电池、燃料电池等)体现化学电池的改进与创新,初步形成科学技术的发展观,感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,初步形成较为客观、正确的能源观。(4)教学模式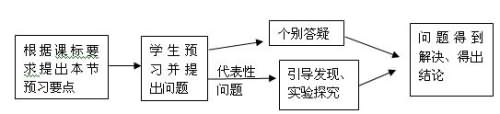 (三)教学目标1. 知识与技能:⑴了解常见的化学能与电能的转化方式⑵举例说明化学能与电能的转化关系及其应用,认识研制新型电池的重要性,形成科学技术的发展观。⑶理解原电池原理及其形成条件2. 过程与方法:⑴通过预习培养学生自学能力、独立解决问题、发现问题的能力。⑵通过实验探究培养学生主动探索科学规律的精神⑶通过思考与交流,让学生学会联系自己已掌握的知识通过比较归纳认识事物的本质特征。3. 情感、态度与价值观⑴培养学生主动参与意识。⑵经历探究过程,提高学生的创新思维能力,勇于探索问题的本质特征,体验科学过程;通过对废旧电池的处理加强环保教育。(四)教学重点初步认识原电池概念、原理、组成及应用。(五)教学难点通过对原电池实验的探究、引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。(六)教学方法预习、实验探究、讨论、启发、讲解、练习(七)课时安排2课时(八)教学工具实验仪器、多媒体教室,另附powerpoint课件。(九)教学过程(第一课时)
(三)教学目标1. 知识与技能:⑴了解常见的化学能与电能的转化方式⑵举例说明化学能与电能的转化关系及其应用,认识研制新型电池的重要性,形成科学技术的发展观。⑶理解原电池原理及其形成条件2. 过程与方法:⑴通过预习培养学生自学能力、独立解决问题、发现问题的能力。⑵通过实验探究培养学生主动探索科学规律的精神⑶通过思考与交流,让学生学会联系自己已掌握的知识通过比较归纳认识事物的本质特征。3. 情感、态度与价值观⑴培养学生主动参与意识。⑵经历探究过程,提高学生的创新思维能力,勇于探索问题的本质特征,体验科学过程;通过对废旧电池的处理加强环保教育。(四)教学重点初步认识原电池概念、原理、组成及应用。(五)教学难点通过对原电池实验的探究、引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。(六)教学方法预习、实验探究、讨论、启发、讲解、练习(七)课时安排2课时(八)教学工具实验仪器、多媒体教室,另附powerpoint课件。(九)教学过程(第一课时)
| 教师活动 | 学生活动 | 设计意图 | ||||||||
【实验探究引入课题】 1、锌片插入稀硫酸 2、铜片插入稀硫酸 3、锌片和铜片上端连接在一起插入稀硫酸 | 学生四人一组分组探究做实验 | 培养学生发现问题的能力、合作能力、动手能力。激发学生学习的兴趣。 | ||||||||
| 【问题探究】 1、锌片和铜片分别插入稀硫酸中有什么现象发生? 2、锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?为什么? 3、锌片的质量有无变化?溶液中c (H+)如何变化? 4、锌片和铜片上变化的反应式怎样书写? 5、电子流动的方向如何? | 通过实验讨论回答 | 培养学生解决问题的能力 | ||||||||
| 【引入】 电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。例如,日常生活中使用的手提电脑、手机、相机、摄像机……这一切都依赖于电池的应用。那么,电池是怎样把化学能转变为电能的呢?这就让我们用化学知识揭开电池这个谜。 | 带着问题进入课堂 | 用疑问将课题引入 | ||||||||
【板书】第二节 化学能与电能 【板书】一、化学能与电能的相互转化 【板书】1、燃煤发电的过程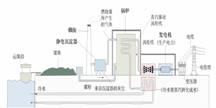 | 学生看书找到答案 | 1、利用学生的生活经验和生动的事例说明电力在当今社会的巨大作用。 2、利用能量守恒定律帮助学生理解火力发电的原理。 3、让学生通过观察图片、图表等直观材料,讨论发现火力发电的利与弊。 | ||||||||
| 教师活动 | 学生活动 | 设计意图 | ||||||||
| 【板书】2、燃烧的本质——氧化还原反应 【分析】氧化还原反应的本质是氧化剂与还原剂之间发生电子转移的过程,电子转移引起化学键的重新组合,伴随着体系能量的变化。要使氧化还原反应释放的能量不通过热能而直接转化为电能,就要设计一种装置,使氧化反应和还原反应分别在两个不同的区域进行。如果要把可产生的电能以化学能的形式储存起来,这就是我们这节课要研究的重要知识点——原电池,这种装置可以将氧化还原反应的能量储存起来,类似于水库的蓄能。 | 复习氧化还原反应的有关内容 | 1、引导学生把氧化剂与还原剂之的电子得失与电流的形成条件联系起来,设想化学能与电能相互转化的方式。 2、鼓励学生讨论设计实现化学能与电能相互转化的实验装置。 | ||||||||
| 【板书】3、原电池 | ||||||||||
 原电池实验探究 原电池实验探究 |
| 利用Cu-Zn原电池实验探究前面“思考与交流”中提出的设想。 | ||||||||
| 【学与问】根据你所了解的电学知识,你知道电子是怎样流动的吗?你如何判定装置的正、负极? | 根据探究实验进行回答 | |||||||||
| 【动画模拟】原电池的微观原理 | 学生观看 | 进一步明确原电池的工作原理 | ||||||||
| 【分析】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。这一变化过程可以表示如下: 锌片:Zn - 2e—= Zn2+ (氧化反应) 铜片:2H+ + 2e— = H2↑ (还原反应) 总反应:Zn+2H+= Zn2++ H2↑ 教师活动 |  学生活动 学生活动 | 引导学生写出反应方程式 引出原电池的概念 设计意图 | ||||||||
| 【板书】(1)原电池的定义——将化学能转变为电能的装置叫做原电池 【板书】(2)原电池的电极 负极:发生氧化反应,电子流出(流向正极)的一极 正极:发生还原反应,电子流入(来自负极)的一极 | ||||||||||
| 【板书】(3)组成原电池的条件 ①有两种活动性不同的金属(或一种是非金属导体)作电极 ②电极材料均插入电解质溶液中(能自发进行氧化还原反应) ③两极相连形成闭合电路 【板书】(4)原电池的原理: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。 | 讨论、引出组成原电池需要的条件、原电池形成条件的探究: ①Zn-Zn与稀硫酸进行实验。 ②Cu-石墨与稀硫酸进行实验。 ③Zn-石墨与稀硫酸进行实验。 ④Fe-Zn与稀硫酸进行实验。 ⑤Cu-Zn与乙醇进行实验。 ⑥Cu-Zn与一个西红柿进行实验。 ⑦Cu-Zn与两个西红柿进行实验 | 提供几种电极材料、电解质和非电解质溶液、水果(也可用果汁代替),启发学生设计实验并进行各种尝试,使学初步学会控制实验条件的方法。经历探究过程,提高学生的创新思维能力,勇于探索问题的本质特征,体验科学过程。 | ||||||||
 【实践活动】课本p39根据构成原电池的条件可知:利用水果如苹果、柑橘、柠檬或番茄等都可以制作原电池。 【实践活动】课本p39根据构成原电池的条件可知:利用水果如苹果、柑橘、柠檬或番茄等都可以制作原电池。 | ||||||||||
【小结】 化学电池的反应本质是——氧化还原反应 1、原电池原理; 2、原电池形成条件; 3、电极反应式的书写。 | ||||||||||
| 【练习巩固】 1.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、 教师活动 | 作业:课本p421、3、 【课外作业】 调查以下项目:常用化学电池的种类、名称、形状、电极、电解 学生活动 | 通过练习巩固知识。 设计意图 | ||||||||
Z三种金属的活动性顺序为( ) (A)X>Y>Z (B)X>Z>Y (C)Y>X>Z (D)Y>Z>X 2.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。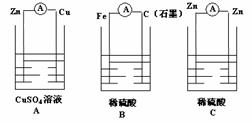 | 质、电压、可否再充电、价格、存放期、特点、用途、回收途径等。列表进行比较或写成调查报告,然后全班交流。 |
 【板书】2、燃烧的本质——氧化还原反应【板书】3、原电池锌片:Zn - 2e-= Zn2+ (氧化反应)铜片:2H+ + 2e- = H2↑ (还原反应)总反应:Zn+2H+= Zn2++ H2↑【板书】(1)原电池的定义——将化学能转变为电能的装置叫做原电池【板书】(2)原电池的电极负极:发生氧化反应,电子流出(流向正极)的一极正极:发生还原反应,电子流入(来自负极)的一极【板书】(3)组成原电池的条件①有两种活动性不同的金属(或一种是非金属导体)作电极②电极材料均插入电解质溶液中(能自发进行氧化还原反应)③两极相连形成闭合电路【板书】(4)原电池的原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。
【板书】2、燃烧的本质——氧化还原反应【板书】3、原电池锌片:Zn - 2e-= Zn2+ (氧化反应)铜片:2H+ + 2e- = H2↑ (还原反应)总反应:Zn+2H+= Zn2++ H2↑【板书】(1)原电池的定义——将化学能转变为电能的装置叫做原电池【板书】(2)原电池的电极负极:发生氧化反应,电子流出(流向正极)的一极正极:发生还原反应,电子流入(来自负极)的一极【板书】(3)组成原电池的条件①有两种活动性不同的金属(或一种是非金属导体)作电极②电极材料均插入电解质溶液中(能自发进行氧化还原反应)③两极相连形成闭合电路【板书】(4)原电池的原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。中考 高考名著
常用成语