金属的腐蚀和防护 教学设计
【教学目标】1、感知生活中金属腐蚀存在及腐蚀的类型;2、了解电化学腐蚀的原理,并对比掌握吸氧腐蚀与析氢腐蚀的异同;3、认识金属防护的一般方法;【教学重难点】 金属的电化腐蚀


 新课导入:(展示各种金属腐蚀的图片)金属腐蚀金属腐蚀的现象在我们身边无处不在,每年给我国带来的损失数以亿计,那作为每一位中华儿女我们可以怎样做呢?你了解金属腐蚀的原理吗?你知道多少种金属防护方法?今天我们就来学习金属的腐蚀与防护的知识。学生活动:阅读教材p54~56金属的腐蚀,归纳总结,尝试回答以下问题:1. 什么是金属腐蚀?2. 金属腐蚀后的特征是什么?3. 金属腐蚀的本质是什么?知识讲解:1. 金属腐蚀:指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程;2. 金属腐蚀后的特征:在外形、色泽以及机械性能等方面都发生一定的变化;3. 本质:金属本身失去电子变成阳离子的过程(发生氧化反应):M – neˉ=== Mn+
新课导入:(展示各种金属腐蚀的图片)金属腐蚀金属腐蚀的现象在我们身边无处不在,每年给我国带来的损失数以亿计,那作为每一位中华儿女我们可以怎样做呢?你了解金属腐蚀的原理吗?你知道多少种金属防护方法?今天我们就来学习金属的腐蚀与防护的知识。学生活动:阅读教材p54~56金属的腐蚀,归纳总结,尝试回答以下问题:1. 什么是金属腐蚀?2. 金属腐蚀后的特征是什么?3. 金属腐蚀的本质是什么?知识讲解:1. 金属腐蚀:指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程;2. 金属腐蚀后的特征:在外形、色泽以及机械性能等方面都发生一定的变化;3. 本质:金属本身失去电子变成阳离子的过程(发生氧化反应):M – neˉ=== Mn+ 设问:从文献当中查找到的已知信息:Fe具有较强的抗腐蚀性,但生活当中我们却经常可以看到Fe生锈的例子,这是为什么呢?钢铁究竟如何被腐蚀掉的呢?知识讲解:4. 金属腐蚀的类型:化学腐蚀:金属跟接触到的物质(如SO2、Cl2、O2等)直接发生化学反应而引起的腐蚀。电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生氧化还原放应,比较活泼的金属失去电子被氧化。探究实验:不同条件下铁钉的锈蚀(视频或动画展示)设问:为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?知识讲解:
设问:从文献当中查找到的已知信息:Fe具有较强的抗腐蚀性,但生活当中我们却经常可以看到Fe生锈的例子,这是为什么呢?钢铁究竟如何被腐蚀掉的呢?知识讲解:4. 金属腐蚀的类型:化学腐蚀:金属跟接触到的物质(如SO2、Cl2、O2等)直接发生化学反应而引起的腐蚀。电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生氧化还原放应,比较活泼的金属失去电子被氧化。探究实验:不同条件下铁钉的锈蚀(视频或动画展示)设问:为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?知识讲解: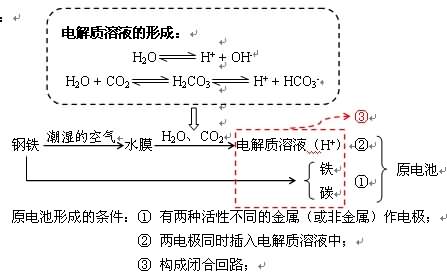
| 析氢腐蚀 | 吸氧腐蚀 | ||
| 发生条件 | 钢铁表面吸附的水膜呈现酸性。 | 钢铁表面吸附的水膜中溶有O2,并呈极弱酸性或中性。 | |
| 电极反应 | 负极 | Fe – 2e–=== Fe2+ | |
| 正极 | 2H++ 2e–=== H2↑ | O2+ 2H2O + 4e–=== 4OH– | |
| 化学腐蚀(次要) | 电化学腐蚀(主要) | |
| 条件 | 金属跟氧化剂直接接触 | 不纯金属或合金跟电解质溶液接触 |
| 现象 | 无电流产生 | 有微弱电流 |
| 本质 | 金属被氧化的过程 | 较活泼的金属被氧化的过程 |
| 相互关系 | 化学腐蚀与电化学腐蚀往往同时发生 | |
(5)采用电化学防护方法,如在钢铁的船体上焊接上较活泼的金属锌。
中考 高考名著
常用成语