硫酸
●教学目标
知识目标
1.掌握浓硫酸的性质,学会检验SO42-的原理和方法。
2.了解浓硫酸的重要用途,认识几种硫酸盐。
能力目标
培养学生的实验观察、分析思维能力。
德育目标
1.对学生进行“现象与本质”“量变与质变”等辩证唯物主义观点的教育
2.通过实验研究,激发学生的学习兴趣,培养学生严谨求实、勇于创新的科学品质
●教学重点
浓硫酸的性质和SO42-的检验
●教学难点
浓硫酸的强氧化性
●教学方法
实验、启发、对比
●教具准备
投影仪、试管、胶头滴管、铁架台、双孔橡皮塞及导气管、酒精灯、砂纸、玻璃棒、大烧杯、胆矾、浓硫酸、纸屑、木条、棉花、铜片、细铜丝、品红溶液、石蕊试液、氢氧化钠溶液、铝条、硫酸铜溶液、蔗糖、蒸馏水、浓盐酸、稀盐酸、稀硫酸、硫酸钠溶液、氯化钡溶液、碳酸钠溶液
●课时安排
2课时
●教学过程
[引言]“会当凌绝顶,一览众山小”。让我们攀越硫的最高山峰![]() ,去领略它特别的风光。(意指浓硫酸的特性)
,去领略它特别的风光。(意指浓硫酸的特性)
[说明]以上物质化学式书写要大,弯箭头和化合价要醒目,可用不同颜色,充分体现层次感,可借投影展出。
[板书]第三节 硫酸(第一课时)
一、硫酸
[投影展示]
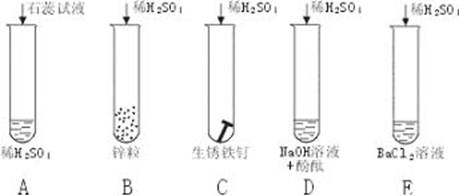
[问题]分述实验现象,归纳稀硫酸的化学性质。
[投影]有关反应的离子方程式:
Zn+2H+=Zn2++H2↑
Fe2O3+6H+=2Fe3++3H2O
OH-+H+=H2O
Ba2++ SO42-=BaSO4↓
[归纳]以上实验验证了稀硫酸五个方面的性质,即酸的通性。
[板书](一)稀硫酸具有酸的通性
[提问]为何稀硫酸具有这些性质呢?
[回答]主要因为硫酸溶于水能电离出H+,是强电解质。
[板书]H2SO4=2H++SO42-
[过渡]浓硫酸与稀硫酸相比,又有哪些特性呢?
[学生阅读]浓硫酸的物理性质
[板书](二)浓硫酸的性质
1.物理性质
[投影]浓硫酸是一种无色油状液体。98.3%的浓硫酸是一种高沸点难挥发的强酸,密度大,极易溶于水,能以任意比与水混溶,溶解时放出大量热,因此稀释浓硫酸时,一定要注意操作规程。
[设疑](投影给出)现有失去标签的浓硫酸、浓盐酸各一瓶(瓶相同,酸体积相同),不用化学方法如何鉴别?根据是什么?
[引导]注意观察、对比。
[回答]①提起试剂瓶掂量,重者为浓硫酸,因为浓硫酸的密度比浓盐酸大。
②拿起试剂瓶摇晃、观察,呈粘稠油状者为浓硫酸,因为浓硫酸是一种粘稠油状液体。
③打开瓶塞观察,瓶口无酸雾者是浓硫酸,因为浓硫酸的沸点高、难挥发。
[学生实验]按小组进行。在试管中放少量胆矾,并滴加少量浓H2SO4,振荡。观察固体和溶液的颜色。
[提问]描述实验现象:固体由蓝变白,溶液仍无色。
[设疑]白色固体为何物?胆矾失去的结晶水是否成为溶剂?溶液为何不变蓝?
[讲解]白色固体为无水硫酸铜,由胆矾失去结晶水而来。失去的结晶水分子与硫酸分子结合,生成了稳定的硫酸水合物,并未成溶剂,所以溶液仍无色。
[投影]H2SO4+nH2O=H2SO4·nH2O(n=1、2、4等)
[追问]浓硫酸使胆矾失去结晶水,说明浓硫酸具有什么样的性质?
[回答]浓硫酸具有吸水性。
[板书]2.特性
(1)吸水性
[讲解]浓硫酸具有吸水性,表现为可直接与水分子结合,因此,实验室常用它做某些气体的干燥剂。
[投影练习]因为浓硫酸难挥发,所以将一瓶浓硫酸敞口放置于空气中,其浓度、质量都不发生变化,对吗?
[回答]不对。浓硫酸会吸收空气中水分而使浓度变小,质量增大。
[演示]实验6—3,浓硫酸与纸屑、棉花、木条的作用。观察它们有何变化。
[提问并回答]纸屑、棉花、木条逐渐变黑,被腐蚀。
[追问]那黑色物质是什么?体现了浓硫酸的什么性质?
[讲解]黑色物质为炭,浓硫酸使它们逐渐变黑的现象称为“炭化”。这是浓硫酸脱水性的体现。
[板书](2)脱水性
[讲解]脱水性是指浓硫酸能将有机物中的氢氧元素按水的组成比例脱去而使其炭化的性质。显然,浓硫酸对皮肤有强烈腐蚀性。使用时,要倍加小心,注意安全。
[设疑]浓硫酸的吸水性和脱水性有何区别?
[引导分析]
[投影小结]吸水性是指浓硫酸直接与水作用形成稳定水合物的性质。脱水性是指浓硫酸可将许多有机物(含C、H、O元素)中的氢氧元素按水的组成比例脱去。
[过渡]稀硫酸可将活泼金属(如Mg、Zn、Al等)氧化,浓硫酸是否可行?
[演示]浓硫酸与铜的反应。如图,反应之后,将试管里的混合液倒入盛少量水的小烧杯中,观察溶液颜色。
[提问]请描述实验现象。
[回答]未加热时,无明显现象。当加热时,液体变黑,产生无色气体,使品红溶液褪色并使石蕊溶液变红。小烧杯中的溶液呈蓝色。
[讨论]铜与浓硫酸反应需什么条件?据实验现象推测反应生成物,注意试管Ⅱ口部棉团的作用,试写出反应方程式。
|
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
[设疑](投影)上述反应中:
①氧化剂、还原剂、氧化产物、还原产物各是何物?
②反应物的物质的量之比,还原剂与氧化剂物质的量之比各为多少?
③浓硫酸在反应中的作用是什么?
[提问并回答]Cu为还原剂,氧化产物为CuSO4,浓H2SO4是氧化剂,还原产物为SO2。反应物的物质的量之比为1∶2,而还原剂与氧化剂的物质的量之比为1∶1,说明浓H2SO4表现了氧化性和酸性。
[思考]上述反应中浓H2SO4的氧化性由其分子中什么原子引起?稀H2SO4是否具有氧化性?两者相比有何差别?可举例说明。
[分析]浓H2SO4的氧化性由其分子中S(最高价)引起。稀硫酸也有氧化性,如Zn+2H+=Zn2++H2↑,由H+表现,而Cu+H2SO4(稀)不反应。可见,H+的氧化性比S的氧化性弱且还原产物不同。
[引导]铜在金属活动性顺序中位于氢之后,而能被浓H2SO4氧化,那么在氢之前的金属是否更容易被其氧化呢?
[板书](3)强氧化性
①氧化大多数金属
[补充演示]铝和浓H2SO4的作用。设计如下:①将一根随时处理完氧化膜的铝条迅速置于盛饱和CuSO4溶液的试管中,过一会儿取出。(可用热NaOH溶液处理氧化膜,整个过程要迅速,以防铝再被氧化)
[分析]铝条表面覆盖红色金属铜:
2Al+3Cu2+=2Al3++3Cu
②把铝条表面的铜用砂纸打掉洗净后,将其插入盛浓H2SO4的试管中,1~2分钟后取出。
[分析]洁净铝条置于浓H2SO4中无明显现象,难道不反应吗?
③把②中的铝条放入饱和CuSO4溶液中,过一会儿取出。
[分析]铝条表面无红色物质析出。①③对比,现象不同,那么在②中一定发生了某种反应。
[阅读]倒数第二自然段。
[讲解]由于浓H2SO4有强氧化性,可使某些金属如Fe、Al等表面因氧化生成一层致密的氧化膜,阻止内部金属继续跟浓H2SO4反应,这种现象称为“钝化”。正因为如此,常温时,常把浓H2SO4存放在铁粉、铝粉容器里。但若加热,则会反应。
④把③中铝条取出,置于浓H2SO4中,加热,观察。
[小结]a.加热条件下,浓H2SO4可氧化绝大多数金属(Au、pt等除外),但不产生H2。
[说明]H之前金属与浓H2SO4反应,产物复杂,大纲不作要求,但要注意反应不产生H2。浓H2SO4与不活泼金属反应,一般被还原为SO2。
b.常温下,浓H2SO4可使Fe、Al钝化。
[强调]“钝化”并非不反应,是因氧化而钝化。
c.浓H2SO4与金属反应表现酸性和氧化性。
[过渡]浓H2SO4的氧化性之强还体现在能跟一些非金属单质发生反应。
[板书]②氧化某些非金属
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
[演示]实验6—3,蔗糖与浓H2SO4的反应。将预先称量的20 g蔗糖放入100 mL烧杯中,加几滴水搅拌均匀,再加入15 mL浓H2SO4,用玻璃棒迅速搅拌。观察物质颜色、体积的变化,闻气味并抚摸烧杯外壁。
[现象]蔗糖由白变黑,体积膨胀,呈疏松海绵状,有刺激性气味气体生成,放出大量的热。
[设疑]蔗糖分子式为C12H22O11,是有机物。请大家根据现象分析,该实验体现了浓H2SO4的哪些性质?
[分析]蔗糖为含C、H、O元素的有机物,遇浓H2SO4会炭化,体现浓H2SO4的脱水性。反应为C12H22O11![]() 12C+11H2O。黑色物质体积膨胀为疏松多孔状,说明有气体产生,那么气体是哪一种,如何形成的?
12C+11H2O。黑色物质体积膨胀为疏松多孔状,说明有气体产生,那么气体是哪一种,如何形成的?
[讲解]浓H2SO4使蔗糖脱水炭化后,又吸水放热,使生成的黑色炭继续被浓H2SO4氧化:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,所以气体有CO2、SO2、水蒸气。体现了浓H2SO4的吸水性、强氧化性。
CO2↑+2SO2↑+2H2O,所以气体有CO2、SO2、水蒸气。体现了浓H2SO4的吸水性、强氧化性。
[小结]该实验是浓H2SO4吸水性、脱水性、强氧化性的共同体现。
[过渡]浓H2SO4还能跟某些具有还原性的化合物反应。
[板书]③氧化某些还原性化合物
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
[总结]本课时重点学习了硫酸的性质。硫酸是典型的强酸,稀硫酸具有酸的通性,浓硫酸还具有强吸水性、脱水性、强氧化性等特性,重中之重是浓硫酸的强氧化性。
[思考]实验证明,浓硫酸的三大特性,稀硫酸都没有;稀硫酸的性质,浓硫酸不完全具备。为什么浓、稀硫酸的性质有这样的差别呢?请从粒子组成及氧化性上分析,并完成下表。
[投影]浓、稀H2SO4的粒子组成及氧化性比较
稀硫酸 | 浓硫酸 | ||
主要粒子H+、SO2- | 4H2SO4分子 | ||
与金属反应 | 只与H之前活泼金属反应,生成H2 | 与H之前金属发生氧化还原反应,产物复杂,不产生H2,常温下使Fe、Al钝化。 加热条件下与H之后金属发生氧化还原反应(Au、pt除外),浓H2SO4一般被还原为SO2 | |
与非金属碳反应 | 不反应 | C+2H2SO4(浓) |
|
浓硫酸—强氧化性—H2SO4分子中S体现—加热时可与绝大多数金属、某些非金属及某些还原性化合物反应,通常生成SO2。
[讲解]稀H2SO4中也有S,为什么稀H2SO4中S不表现氧化性呢?这是因为S存在于SO42-中,只有在H2SO4分子中才表现强氧化性。可见,由于H2SO4溶液浓度不同(即所含溶质的量不同),而导致其氧化性的不同,表现为反应情况不同,产物不同(即:量变引起质变),也正因为浓H2SO4中的粒子主要是H2SO4分子,所以浓H2SO4与固体的反应不用离子方程式表示。
由于H2SO4溶液的浓度不同造成溶液中的粒子不同(本质),导致性质差别(现象)。
学习中大家要善于透过现象看其本质。
[转引]硫酸和可溶性硫酸盐溶于水时,都会电离产生硫酸根离子,那么如何检验硫酸根离子是否存在呢?
[板书]三、硫酸根离子的检验
[提问]如何检验Cl-,根据是什么?
[回答]加AgNO3溶液和稀硝酸,若产生白色沉淀,则溶液中Cl-存在。根据是AgCl是一种既不溶于水又不溶于稀硝酸的白色固体。
[追问]实验中加入稀硝酸的作用是什么?试解释。
[回答]防止CO 等杂质离子的干扰。因Ag2CO3同AgCl一样,是不溶于水的白色固体,但Ag2CO3可溶于硝酸,而AgCl则不溶。可以,再加稀硝酸以确定沉淀是否为AgCl。
[追问]硫酸盐中有否类似于AgCl的物质?
[回答]有,BaSO4
[学生实验](按小组进行)
取两支洁净的试管分别取少量硫酸和硫酸钠溶液,向其中各滴入几滴BaCl2溶液,观察发生的现象,再加入少量稀盐酸(或稀硝酸),振荡、观察。
[现象]两试管中均产生白色沉淀,加稀盐酸(或稀硝酸)后,沉淀不消失。
[学生实验]取少量Na2CO3溶液并滴加少量BaCl2溶液,观察现象,再加入少量稀盐酸(或稀硝酸),振荡、观察。
[现象]生成白色沉淀,加稀盐酸(或稀硝酸)后,沉淀消失,同时产生无色气体。
[问题]请写出有关反应的化学方程式
[学生板演]H2SO4+BaCl2=BaSO4↓+2HCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
BaCO3+2HCl=BaCl2+H2O+CO2↑
[讲述]BaSO4、BaCO3同为不溶于水的白色固体,但BaCO3可溶于盐酸(或硝酸),通过加酸可将两者区别。
[板书]试剂:可溶性钡盐和稀盐酸
方法:先加盐酸酸化,再加BaCl2溶液。
[讨论]为何先用盐酸酸化?
[讲述]当往待验液中加BaCl2溶液时,若溶液中存在Ag+、CO32-、SO32-等离子时,均会出现白色沉淀。若先用盐酸酸化,则可排除干扰。因为盐酸可将CO32-、SO32-转化为气体,而AgCl既不溶于水又不溶于盐酸,若有,则可取上层清液进行实验。
[讨论]检验SO42-时,能否用稀硝酸酸化?
[讲解]不能。因HNO3有强氧化性,若溶液中存在SO32-,硝酸可将其氧化成SO42-,从而造成误检。
[强调]1.加入盐酸酸化以排除CO32-、SO32-、Ag+等的干扰。
2.不用硝酸酸化,防止SO32-被氧化成SO42-而造成干扰。
[练习]在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液( )
A.一定含有SO42- B.一定含有Ag+
C.一定含有SO32- D.一定含有Ag+或SO42-
E.可能含有Ag+或SO32-或SO42-
答案:E
[讨论]课本p137,如何用实验方法鉴别NaCl、Na2SO4、NaNO3、Na2CO3四种溶液?
[讲述]实验步骤:
1.用四支洁净的试管,分别取四种溶液少许,再分别滴加BaCl2溶液,产生白色沉淀者原溶液为Na2SO4和Na2CO3,无明显现象者为NaCl和NaNO3溶液。
2.往产生白色沉淀的两支试管中分别滴加稀盐酸(或稀硝酸),振荡,沉淀溶解并产生气体者原溶液为Na2CO3,另一是Na2SO4溶液。
3.用两支洁净试管分别取另两种原溶液,再分别滴加AgNO3溶液,产生白色沉淀者原溶液为NaCl,无明显现象者是NaNO3溶液。
[投影]有关反应的离子方程式:
SO42-+Ba2+=BaSO4↓
CO32-+Ba2+=BaCO3↓
BaCO3+2H+=Ba2++H2O+CO2↓
Cl-+Ag+=AgCl↓
[参考练习](投影)
1.下列现象反映了硫酸的哪些主要性质(填空):
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
答案:脱水性 吸水性 酸性 酸性和强氧化性 难挥发性 强氧化性 强酸性
2.常温下,下列物质可盛放在铁制容器中的是( )
A.盐酸 B.稀硫酸 C.浓硫酸 D.硫酸铜溶液
解析:此题考察有关物质的性质及反应。盐酸、稀硫酸与铁发生反应:Fe+2H+=Fe2++H2↑,铁被腐蚀;硫酸铜溶液可与铁发生反应:Cu2++Fe=Cu+Fe2+,铁被腐蚀;常温下,浓硫酸可使铁钝化而生成保护膜。所以选择答案C。
答案:C
3.用一无色盐溶液作下列实验,能证明溶液中一定含有SO42-的是( )
A.加入Ba(NO3)2溶液产生白色沉淀,再加盐酸沉淀不消失
B.加入BaCl2溶液产生白色沉淀,再加稀硝酸沉淀不消失
C.先用盐酸酸化,再加Ba(NO3)2溶液产生白色沉淀
D.以上都不能证明
解析:A中白色沉淀可能是BaSO3,再加盐酸时,由于溶液中有NO3-,那么有BaSO3![]() BaSO4转化,宏观看沉淀不消失。该选项最易被误选。
BaSO4转化,宏观看沉淀不消失。该选项最易被误选。
B中白色沉淀有BaSO4、AgCl两种可能。
C中先用盐酸酸化,可排除SO32-、CO32-、Ag+等离子的干扰。
答案:C
4.用等体积等物质的量浓度的氯化钡溶液可使相同体积的硫酸铁、硫酸亚铁、硫酸钾三种溶液中的硫酸根离子完全转化为沉淀。则三种溶液的物质的量浓度之比为( )
A.1∶1∶1 B.1∶2∶3 C.3∶1∶1 D.1∶3∶3
解析:反应本质为Ba2++SO42-=BaSO4↓,据题n(Ba2+)一定,则等体积三种硫酸盐中SO42-呈相等关系,再根据硫酸盐的组成可判断其溶液物质的量浓度为1∶3∶3。
●教学说明
围绕教学重点、难点,主要采用了实验、启发、对比、设疑相结合的方法。
1.充分利用化学实验这一重要媒体,引导学生观察、分析、推理、抽象概括,从而认识浓硫酸的特性。教学中补充演示浓硫酸使铝钝化及其钝化层被破坏的实验,有助于理解钝化的实质和条件,避免了通常“纸上谈兵 ”的枯燥教法。通过演示、设疑、学生实验,加强了教学的直观性、生动性,调动了学生主体积极性和趣味性,训练了学生实验、观察、分析、思维及解决问题的能力。
2.通过对比浓硫酸、稀硫酸的粒子组成,能使学生从本质上认识它们氧化性的差别。同是渗透量变引起质变、透过现象看到本质的辩证唯物主义思想。
3.教学中适时设疑、层层设疑,有利于重点难点知识的突破与跨越,同时培养学生独立思考的习惯。课后设置实验问题,目的是发展学生的创造力,提高学生的知识迁移和综合应用能力。
中考 高考名著
常用成语