常见的碱 碱的通性 教案
常见的碱 碱的通性
第一课时
重点难点: 氢氧化钠的化学性质是重点,碱和非金属氧化物反应的化学方程式书写难点。
教学方法: 实验探讨法
教学用品 仪器:试管、镊子、表面皿、平底烧瓶、滴管、单孔塞、玻璃管。
药品:氢氧化钠固体、石蕊试液、酚酞试液、氯化铁溶液、硫酸铜溶液、氢氧化钠溶液。
其它:小气球。
教学过程:
1、回忆、回答碱的概念,写出电离方程式:
[引言] 碱有哪些性质呢?今天我们学习氢氧化钠这种常见的碱。
[演示实验] 氢氧化钠的物理性质,课本p.165(实验8-23)将少量氢氧化钠分别放在几个表面皿上,给各组学生,引导学生仔细观察其色态,在空气中放置一会儿,固体氢氧化钠表面的变化;再将其中的一块放入盛有少量水的大试管里振荡,并让学生触摸管外壁温度的变化。
从感性上认识氢氧化钠物理性质,培养学生观察能力。
[小结] 指导学生小结氢氧化钠的物理性质。
[板书] 一、氢氧化钠(NaOH)
俗称:烧碱、火碱、苛性钠
(一)物理性质
[问题讨论] 根据氢氧化钠易潮解的性质,你能想到它有什么用途?
思考、讨论:氢氧化钠可干燥某些气体。
[板书] (二)化学性质
1.NaOH溶液与酸碱指示剂反应
[实验] 指导学生做氢氧化钠溶液与石蕊试液和酚酞试液反应的实验。
2.氢氧化钠与非金属氧化物的反应
[提问] 请同学们想一想,石灰水中通往二氧化碳有何现象?是哪类物质间的反应?写出化学方程式。
现象:白色沉淀生成;是碱与非金属氧化物的反应。
Ca(OH)2+CO2=CaCO3↓+H2O
那么,NaOH能否与CO2反应呢?请同学们观察实验,并思考实验现象中的道理。
[演示实验] 氢氧化钠与二氧化碳反应在充满二氧化碳的烧瓶中,加入少量氢氧化钠浓溶液,迅速塞紧带有玻璃管和气球的橡皮塞,振荡烧杯,观察现象、思考问题。
[问题讨论]
为什么气球会逐渐涨大?
碱与非金属氧化物反应的化学方程式如何写?
怎样保存氢氧化钠?说明原因?
指导学生完成化学方程式。
讨论气球涨大的原因,最后得出氢氧化钠能与二氧化碳反应的正确结论。
反应方程式:CO2+2NaOH=Na2CO3+H2O 与CO2与Ca(OH)2反应对照
CO2+Ca(OH)2=CaCO3↓+H2O
分析如何保存NaOH及原因。
3.氢氧化钠与酸反应(中和反应)
在讲酸的性质时,我们学习了酸与碱的中和反应,这也是碱的重要性质。
练习:写出HCl、HNO3与Ca(OH)2反应的化学方程式:
加强化学方程式书写练习,加深理解NaOH性质。
4.氢氧化钠与某些盐的反应
[实验] 氢氧化钠跟某些盐的反应,课本p.166(实验8-24)
描述现象、书写化学方程式:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
[小结] 组织学生共同总结氢氧化钠的化学性质。
记录、记忆反应规律。
[设问]我们学习了氢氧化钠的性质,那么它有哪些用途呢?
[板书] (三)氢氧化钠的用途
教师结合本地区简述烧碱生产和应用。
请看书p.166 总结、回答。
对学生进行国情、市情和受国主义思想教育。
第二课时
重点难点 氢氧化钙的化学性质是重点,碱的通性是难点。
教学方法 实验、对比、归纳教学法。
教学用品 仪器:蒸发皿、镊子、烧杯、药匙、玻璃棒、试管、滴管、玻璃管。
药品;氢氧化钙粉末、生石灰、氢氧化钙溶液、浓碳酸钠溶液、石蕊试液、酚酞试液、稀盐酸。
教学过程
[复习提问] 上节我们学习了氢氧化钠,请同学们想一想:
1.氢氧化钠有哪些物理性质?如何保存?
2.写出下列物质间反应的化学方程式:
氢氧化钠溶液与二氧化碳;
氢氧化钠溶液与硝酸;
氢氧化钠溶液与氯化铁溶液。
[引言] 在学习了氢氧化钠这种常见的碱之后,今天我们学习另一种常见的、重要的碱—氢氧化钙。
[设问] 氢氧化钙欲称熟石灰或消石灰,它是怎样制得的呢?(结合日常生活中的所见所闻思考)
[演示实验] 氢氧化钙的制取
课本p.167 (实验8-25)
请两位同学将近日自制的熟石灰粉末拿出来给同学们观察,最后送到讲台上。
学生观察现象,分析产物,写出反应的化学方程式:
CaO+H2O=Ca(OH)2
[板书] 二、氢氧化钙Ca(OH)2
(一)用生石灰与水反应制取熟石灰
[演示实验] 氢氧化钙的溶解性 课本p.167(实验8-26) 注意引志学生观察现象并与氢氧化钠相比较。
观察物质色态,在水中溶解的情况,并与氢氧化钠的溶解性进行比较,总结出氢氧化钙的物理性质。
[板书](二) 氢氧化钙物理性质
1.色态
2.溶解性
[实验]分别请三位同学到讲台上来做实验:
氢氧化钙溶液与批示剂反应
向石灰水中吹入二氧化碳
向石灰水中滴加盐酸。
观察分析、回答问题:
1.描述各反应现象,并与氢氧化钠性质对比。
2.找出实验操作中存在的问题加以更正。
在实验、讨论基础上,总结出氢氧化钙的化学性质。
[板书] (三)氢氧化钙化学性质
1.与酸碱指示剂作用
2.与非金属氧化物反应
3.与酸反应(中和反应)
[实验] 教师指导学生完成实验课本p.167(实验8-28)
[思考] 这个实验证明氢氧化钙还具有什么化学性质?你能否写出反应的化学方程式?
[板书] 4. 与某些盐反应。
实验证明石灰水能与某些盐反应,这是氢氧化钙的又一条重要化学性质,根据现象,分析产物,写出化学方程式。
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
根据氢氧化钙的性质分析它可能有哪些用途?并看书p.167~p.168。引导学生规纳、小结出Ca(OH)2的用途。
[板书] (四)氢氧化钙的用途
我们学习了氢氧化钠、氢氧化钙这两种常见的、重要的碱之外,还有KOH、Fe(OH)3、Cu(OH)2等许多碱,它们如何命名呢?请同学们看书p。168"三、碱的命名",并将命名方法进行小结。
[板书] 三、碱的命名
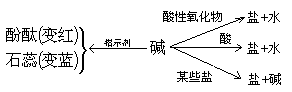
[设问] 通过NaOH、Ca(OH)2一系列的化学实验,我们知识它们具有相似的化学性质, 叫碱的通性,请思考原因。
碱类具有相似的化学性质的原因是:它们具有相似的结构。
[板书] 四、碱的通性
因为;
碱![]()
所以碱具有通性。
引导学生用相互关系图,归纳出碱的通性。
总结归纳出如下的相互关系图:
[设问] 什么叫酸性氧化物?指导学生看书p.168。
[指导学生小结] 本节我们重点学习了Ca(OH)2的化学性质及碱的通性,了解了Ca(OH)2的制取、用途物理性质及碱的命名。
中考 高考名著
常用成语